Tôm trắng Litopenaeus vannamei đã trở thành loài tôm nuôi quan trọng nhất ở Trung Quốc nhờ vào tốc độ tăng trưởng nhanh và khả năng thích nghi mạnh mẽ. Gần đây, bệnh tật đã trở thành vấn đề nghiêm trọng gây ra tổn thất kinh tế lớn trong ngành nuôi tôm (Jayasree, Janakiram & Madhavi 2006; Chiu, Guu, Liu, Pan & Cheng 2007). Do đó, việc phát triển các giải pháp để nâng cao khả năng kháng bệnh và sống sót của tôm trước nhiễm trùng do vi sinh vật là rất quan trọng để duy trì ngành nuôi tôm.
Các hóa chất và kháng sinh được sử dụng rộng rãi để ngăn ngừa hoặc điều trị các nhiễm trùng như vậy (Helena Rebouças, Viana de Sousa, Sousa Lima, Roger Vasconcelos, de Carvalho & dos Fernandes Vieira 2011). Việc sử dụng các loại thuốc kháng khuẩn này trong nuôi trồng thủy sản có những tác động tích cực; tuy nhiên, một số nguy cơ và tác dụng phụ đối với cả tôm và môi trường đều gắn liền với việc sử dụng chúng quá mức (Yonar 2012). Những điều này bao gồm ức chế miễn dịch, giảm tăng trưởng và gia tăng tỷ lệ nhiễm các chủng vi khuẩn kháng thuốc (Zaki, Eissa & Saeid 2011), các vấn đề môi trường như tồn dư thuốc trong trầm tích nuôi trồng cùng với tồn dư thuốc trong sản phẩm tôm (Saglam & Yonar 2009).
Florfenicol (FLR) là loại thuốc kháng khuẩn được sử dụng phổ biến nhất trong nuôi trồng thủy sản toàn cầu, đây là một loại thuốc tổng hợp có cấu trúc hóa học và phổ hoạt động diệt khuẩn tương tự như chloramphenicol, và đã được chứng minh có hoạt tính mạnh đối với một số loại vi khuẩn gây bệnh (Caipang, Lazado, Brinchmann, Berg & Kiron 2009; Fodey, George, Traynor, Delahaut, Kennedy, Elliott & Crooks 2013). Các nghiên cứu trước đây về dược động học của FLR trong nuôi trồng thủy sản chủ yếu được thực hiện trên cá có vây (Malvisi, Della Rocca, Anfossi, Tomasi, Di Salvo, Zanchetta, Magni, Sello & Giorgetti 2002; Lewbart, Papich & Whitt-Smith 2005; Park, Lim, Kim & Yun 2006; Sun, Zhao, Shan, Zhu, Zeng & Liu 2010; Lim, Kim, Hwang, Song, Park & Yun 2011; Zaki et al. 2011; Zhao, Zhang, Bai, Zhu, Shan, Zeng & Sun 2011).
Kết quả cho thấy thuốc được hấp thụ nhanh chóng, phân phối rộng rãi và khả năng sinh học của FLR dao động từ 91% đến 99% trong cá nước biển là rất tuyệt vời. Christensen, Ingerslev và Baun (2006) phát hiện rằng FLR cũng có khả năng điều trị vibriosis và nhiễm trùng viêm tụy hoại tử ở tôm nuôi. Dữ liệu dược động học có sẵn cho cá có vây có thể không áp dụng, vì tôm là loài có giải phẫu và sinh lý rất khác biệt. Thực tế, có một số bằng chứng cho thấy tôm có thể chuyển hóa và thải ra thuốc chậm hơn so với động vật có xương sống. Mặc dù FLR đã được FDA phê duyệt sử dụng trong nuôi tôm, nhưng rất ít thông tin được biết đến về dược động học của FLR trong tôm.
Các đặc điểm dược động học của FLR trong tôm cần được hiểu rõ hơn để xác định các chế độ liều tối ưu nhằm đạt được và duy trì mức độ thuốc điều trị cũng như dự đoán thời gian rút lui tồn dư trong các mô ăn được của tôm điều trị. Do đó, cần điều tra dược động học và các cơ chế tương ứng của FLR trong L. vannamei.
Các loại thuốc thường có tính kỵ nước, điều này cho phép chúng đi vào vị trí tác động của các cơ quan hoặc mô mục tiêu qua màng tế bào và phát huy tác dụng. Là các hợp chất tan trong lipid, chúng khó bị khử từ cơ thể. Chuyển hóa, hay sự biến đổi sinh học của các hợp chất này thành các chuyển hóa không hoạt động, thường là một quá trình enzym (Topic Popovic, Klobucar, Strunjak-Perovic, Jadan, Barisic & Coz-Rakovac 2013). Con đường chủ yếu để loại bỏ các chất ngoại lai ưa lipid gồm có quá trình chuyển hóa trung gian do cytochrome P450s (CYP450s) thực hiện ở gan động vật có xương sống hoặc các mô không xương sống tương tự (Rewitz, Styrishave, Løbner-Olesen & Andersen 2006).
CYP450s bao gồm một họ gen đa dạng các hemoprotein chịu trách nhiệm cho sự chuyển hóa của nhiều chất ngoại lai, bao gồm thuốc điều trị, hóa chất môi trường và thành phần dinh dưỡng, cũng như các hợp chất nội sinh như steroid và axit mật (Rewitz et al. 2006). Diễn biến mRNA của gen P450, mức độ protein và chuyển hóa các chất ngoại lai do P450 thực hiện đã được kích thích ở một số loài động vật không xương sống biển. Do đó, điều chỉnh hoạt động enzym P450 có thể đóng một vai trò trung tâm trong việc thích ứng của động vật với các chất ô nhiễm môi trường. Cần chú trọng làm rõ chức năng và sự điều chỉnh của số lượng P450 ngày càng gia tăng ở động vật không xương sống biển.
CYP450 của gia đình CYP1, CYP2, CYP3 và CYP4 chủ yếu tham gia vào quá trình giải độc các chất ngoại lai (James & Boyle 1998). Isozyme CYP 1A1 là loại phổ biến nhất (Dam, Rewitz, Styrishave & Andersen 2008), và hoạt động ethoxyresorufin-O-deethylase (EROD) có thể phản ánh hoạt động của nó (Rewitz et al. 2006). Ở giai đoạn II, các chuyển hóa của chất ngoại lai sẽ được kết hợp với các thành phần nội sinh ưa nước như glutathione-S-transferase (GST), để tạo ra các hợp chất kết hợp tan trong nước dễ dàng thải ra (Rey-Salgueiro, Costa, Ferreira & Reis-Henriques 2011). Phòng thí nghiệm của chúng tôi đã lập bản đồ hệ gen của tôm trắng L. vannamei (Số hiệu: SRR346404, chưa công bố). Điều này cho thấy L. vannamei dường như có các gen đồng hình của một số enzym chính liên quan đến các bước chuyển hóa, bao gồm CYP1A1, CYP3 và CYP4, cung cấp bằng chứng mạnh mẽ cho sự tồn tại của các con đường enzym kiểu động vật có xương sống trong L. vannamei.
Việc sử dụng kháng sinh trong thức ăn đã được coi là cách thuận tiện nhất để điều trị động vật nuôi (Fang, Li, Zhou, Li, Hu & Zhou 2013), một phần do lượng thuốc cần thiết cho loại điều trị này thấp hơn đáng kể so với việc cho qua nước và do đó, lượng tồn dư vào môi trường xung quanh cũng thấp hơn. Mục tiêu của nghiên cứu này là (i) đánh giá sự phân bố và thải trừ của FLR, và (ii) điều tra các enzym và mức độ mRNA của các gen liên quan đến chuyển hóa trong tôm trắng khỏe mạnh sau khi sử dụng đường uống. Các thông số được trình bày ở đây sẽ hữu ích cho các nghiên cứu tiếp theo về dược động lực học và quá trình chuyển hóa của thuốc kháng sinh.
Kết quả
Phân bố và thải trừ trong mô
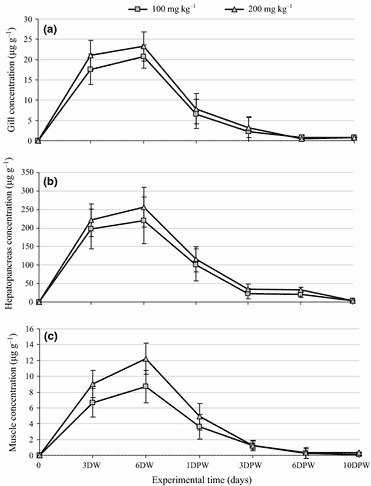
Các nồng độ FLR trong các mô trong và sau khi sử dụng đường uống với liều 100 và 200 mg kg−1 được thể hiện trong Hình 1. Trong suốt quá trình sử dụng đường uống FLR, nồng độ FLR trong ba mô tăng lên và đạt đỉnh vào ngày thứ 6. Sự phân bố của FLR khác nhau giữa các mô. Tụy gan có nồng độ FLR cao nhất, theo thứ tự là tụy gan> mang> cơ bắp. Sau khi ngừng dùng FLR, nồng độ FLR bị giảm nhanh chóng đến 3 ngày sau khi ngừng thuốc.
Các thông số enzym
Hoạt động EROD
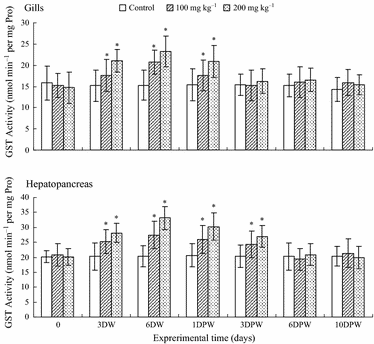
Các tác động của việc sử dụng đường uống FLR lên phản hồi EROD ở mang và tụy gan được thể hiện trong Hình 2. Kết quả cho thấy rằng hoạt động EROD ở mang và tụy gan của các nhóm điều trị 100 và 200 mg kg−1 đã tăng lên và trở nên khác biệt một cách đáng kể so với giá trị đối chứng vào ngày thứ 3 của việc ăn FLR. Sau khi ngừng sử dụng FLR, hoạt động EROD ở mang và tụy gan của cả hai nhóm điều trị giảm xuống, và vào ngày thứ 6 sau khi ngừng thuốc, hoạt động EROD trở lại mức ban đầu.
.png)
Hoạt động GST
Kết quả hoạt động GST ở mang và tụy gan được trình bày trong Hình 3. Nó cho thấy rằng sự thay đổi của hoạt động GST ở mang và tụy gan có một mẫu tương tự: trong giai đoạn cho ăn bằng FLR, hoạt động GST đã tăng lên và đạt đỉnh vào ngày thứ 6.
Biểu hiện của các gen liên quan đến chuyển hóa
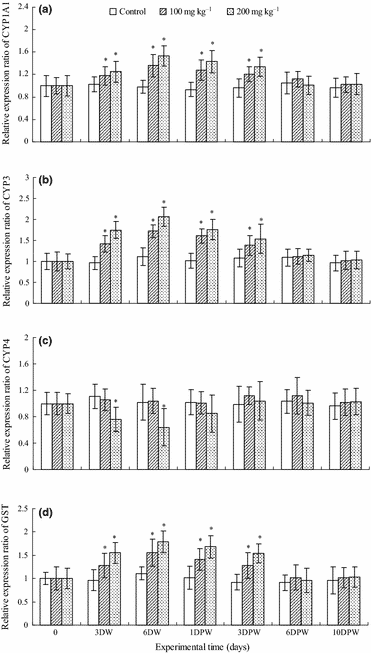
Các tác động của việc sử dụng đường uống FLR lên biểu hiện mRNA của các gen liên quan đến chuyển hóa ở tụy gan tôm trắng đã được xác định (Hình 4). Trong giai đoạn cho ăn bằng FLR, cả hai mức điều trị FLR đều làm tăng biểu hiện mRNA của CYP1A1, CYP3 và GST một cách đáng kể theo liều. Sau khi ngừng cho ăn bằng FLR, biểu hiện mRNA của CYP1A1, CYP3 và GST giảm, và trở lại mức ban đầu vào ngày thứ 6 sau khi ngừng FLR.
Thảo luận
Phân bố và thải trừ FLR trong L. vannamei
Tại các loài giáp xác, có bằng chứng substancial cho thấy tụy gan không chỉ đóng vai trò trong chuyển hóa và thải trừ mà còn trong hấp thụ (Verri, Mandal, Zilli, Bossa, Mandal, Ingrosso, Zonno, Vilella, Ahearn & Storelli 2001; Faroongsarng, Chandumpai, Chiayvareesajja & Theapparat 2007). Sau khi sử dụng đường uống, thuốc được chuyển từ dạ dày của tôm đến tụy gan, nơi mà cả việc hấp thụ thuốc vào và thải trừ ra khỏi cơ thể diễn ra một cách cạnh tranh (Tu, Silvestre, Phuong & Kestemont 2010). Trong nghiên cứu hiện tại, nồng độ pic của FLR trong tụy gan cao hơn so với ở mang và cơ bắp, điều này càng cho thấy rằng thuốc đã được hấp thụ từ dạ dày vào tụy gan của tôm. Sau 6 ngày sử dụng đường uống FLR, thứ tự giảm theo nồng độ pic của FLR là tụy gan> mang> cơ bắp.
Nồng độ tối đa được tìm thấy trong tụy gan, đây là đặc điểm chính của việc sử dụng đường uống. Hiện tượng này cũng được ghi nhận ở các loài giáp xác khác, chẳng hạn như sulfadimethoxine trong tôm hùm Mỹ Homarus americanus (James & Barron 1987), ormetoprim trong tôm Penaeus vannamei (Park, Lightner, Milner, Mayersohn, Park, Gifford & Bell 1995), triclopyr trong tôm hến Orconectes propinquus (Barron, Hansen & Ball 1991), và oxytetracycline trong tôm trắng Thái Bình Dương (Faroongsarng et al. 2007). Là một cơ quan hô hấp, mang tiếp xúc trực tiếp với nước, nồng độ thuốc trong mang cao hơn trong cơ. Điều này cho thấy rằng như các loài cá có vây, mang cũng đóng vai trò quan trọng trong việc thải trừ thuốc. Quan sát này không tương thích với những phát hiện ở một số loài cá có vây.
Thứ tự nồng độ FLR trong cá tilapia nước ngọt sau liều uống đơn 10 mg kg−1 trọng lượng cơ thể của FLR là thận> mang> gan> cơ (Feng, Jia & Li 2008), và thứ tự nồng độ FLR trong cá chép sau một liều tiêm đơn 80 mg kg−1 là thận> cơ> gan> mang (Huang, Sun, Li & Huang 2006). Những kết quả này chỉ ra rằng dược động học của FLR bị ảnh hưởng bởi các thông số như loài, cách sử dụng và điều kiện thí nghiệm (Intorre, Cecchini, Bertini, Cognetti Varriale, Soldani & Mengozzi 2000). Đối với lý do này, việc suy diễn dữ liệu dược động học thu được từ một loài sang loài khác, sống trong các điều kiện khác nhau, cần phải được thực hiện cẩn thận (Haug & Hals 2000; Pontes, Arruda, de Lara, Menezes & Pereira de Lima 2006).
Việc thiết kế các chế độ điều trị và dự đoán kết quả lâm sàng của chúng đại diện cho một ứng dụng quan trọng của dữ liệu dược động học. Thường thì, hiệu quả của một loại thuốc kháng khuẩn liên quan đến khả năng của nó để đạt được và duy trì nồng độ đủ tại vị trí nhiễm trùng. Đối với một loại thuốc kháng khuẩn như FLR, Shojaee AliAbadi và Lees (2000) gợi ý rằng một chế độ tối ưu nên duy trì nồng độ tại vị trí nhiễm trùng vượt quá giá trị nồng độ ức chế tối thiểu (MICs) cho mầm bệnh liên quan trong suốt thời gian điều trị. Feng và Jia (2009) đã báo cáo rằng giá trị MICs của FLR đối với một số mầm bệnh gram âm và gram dương rất thấp (≤1.6 μg mL−1).
Roque, Molina-Aja, Bolán-Mejía và Gomez-Gil (2001) đã xác định độ nhạy in vitro với FLR của 98 chủng Vibrio spp. (là vi khuẩn có thể gây ra bệnh. Vibriosis là bệnh do Vibrio spp gây ra) được phân lập từ tôm ở tây bắc Mexico, và giá trị MIC trung bình là 1.79 μg mL−1. Kết quả của chúng tôi cho thấy rằng nồng độ trong tất cả các mô dao động từ 1.81 đến 35.23 μg g−1 sau 3 ngày sử dụng đường uống, vượt quá các giá trị MIC trên với khoảng cách lớn, trong khi vào 6 ngày sau khi sử dụng đường uống, nồng độ trong tất cả các mô thấp hơn các giá trị MIC. Do đó, sau 6 ngày sử dụng đường uống và với thời gian rút lui 3 ngày với liều 100 mg kg−1 FLR với kháng sinh được đưa vào thức ăn một cách hợp lý, FLR nên phù hợp để điều trị các nhiễm trùng vi khuẩn phổ biến này trong nuôi tôm. Ngoài ra, vẫn cần thực hiện các nghiên cứu như vậy trong điều kiện nuôi trồng tự nhiên.
Quá trình chuyển hóa của FLR trong L. vannamei
Đã có một số nghiên cứu về quá trình chuyển hóa của kháng sinh trong cá; tuy nhiên, các tác động của chúng đối với phản ứng chuyển hóa chưa được nghiên cứu tốt ở giáp xác. Sự biến đổi sinh học của các chất ngoại lai trong các loài eukaryote thường được khởi động bởi một phản ứng monooxygenase (giới thiệu một nhóm oxy chức năng), do các enzym cytochrome P450 (giai đoạn I) xúc tác. CYP1A1 ở giáp xác đã được nghiên cứu rộng rãi như là một dấu hiệu sinh học trong giám sát sinh học hoặc đánh giá độc tính, có thể được đánh giá bằng cách đo EROD (Rocha, Gomes, Passos, Hasue, Santos, Bicego, Taniguchi & Ngan 2012).
Ở giai đoạn II, các chuyển hóa được kết hợp với các thành phần nội sinh ưa nước để tạo ra các hợp chất kết hợp tan trong nước dễ dàng thải ra. Glutathione-S-transferase (GST) là một enzym trong quá trình chuyển hóa giai đoạn II, đã được xác định là một dấu hiệu sinh học phù hợp cho sự ô nhiễm nước. Trong nghiên cứu của chúng tôi, chúng tôi đã quan sát thấy sự gia tăng đáng kể trong hoạt động EROD và GST ở cả hai mô ở liều 100 và 200 mg kg−1 FLR so với nhóm đối chứng. Những kết quả này gợi ý rằng các enzym EROD và GST đóng một vai trò quan trọng trong quá trình giải độc của FLR.
Các nghiên cứu cho đến nay về sự biến đổi sinh học trong tụy gan và các mô không nội tiết khác ở giáp xác đã chỉ ra rằng các chất nền thường được chuyển hóa ở động vật có vú bởi các họ CYP2 và CYP3, chẳng hạn như benzphetamine, aminopyrine, erythromycin, imipramine và hormone steroid (các con đường phân hủy) là các chất nền tốt hơn cho CYP 450s ở giáp xác hơn là các chất nền thường được chuyển hóa bởi họ CYP1, chẳng hạn như ethoxyresorufin (James & Boyle 1998). Ở người, CYP3 được cho là đóng vai trò trung tâm trong chuyển hóa thuốc vì nó chịu trách nhiệm cho việc chuyển hóa số lượng lớn nhất các loại thuốc hiện đang được sử dụng (Watkins 1994).
Như trong hệ thống động vật có vú, CYP3A đã được tìm thấy trong cá, đã báo cáo rằng CYP3A có thể bị kích thích bởi các hóa chất steroid và bởi nhiều hợp chất khác nhau, bao gồm các glucocorticoids tự nhiên và tổng hợp cũng như các kháng sinh macrolide (được xem xét trong Quattrochi & Guzelian 2001). GST là một trong những gen được nghiên cứu nhiều nhất trong giáp xác liên quan đến chuyển hóa các chất ô nhiễm. Gonçalves-Soares, Zanette, Yunes, Yepiz-Plascencia và Bainy (2012) đã báo cáo rằng sau khi tiêm một liều độc tính không gây chết của chiết xuất độc Microcystis aeruginosa vào L.vannamei, MCs đã gây ra sự tăng cường cho GST. Theo kiến thức của chúng tôi, nghiên cứu này là nghiên cứu đầu tiên khám phá tác động của việc sử dụng đường uống kháng sinh lên sự phiên mã của các gen được chọn liên quan đến hệ thống chuyển hóa ở tôm trắng.
Trong kết quả của chúng tôi, trong số các gen liên quan đến chuyển hóa, FLR đã dẫn đến sự tăng cường phiên mã của CYP1A1, CYP3 và GST trong suốt quá trình sử dụng đường uống kháng sinh và tiếp tục thể hiện mức độ biểu hiện này cho đến ngày thứ nhất sau khi ngừng thuốc. Biểu hiện mRNA của CYP1A1 và GST cũng như các enzym liên quan EROD và hoạt động GST có xu hướng tương tự. Sau 6 ngày sử dụng đường uống FLR, biểu hiện mRNA của CYP1A1 và GST cùng với hoạt động của các enzym liên quan EROD và GST đã đạt mức cao nhất của chúng. Sau khi dừng cho ăn FLR, biểu hiện các gen và hoạt động enzym trở lại mức ban đầu vào ngày thứ 3 sau khi ngừng FLR.
Trước đây đã có giả thuyết rằng các enzym CYP4 ở côn trùng liên quan đến sự chuyển hóa của các chất ngoại lai (Danielson, Foster, McMahill, Smith & Fogleman 1998). Những kết quả nói trên cho thấy rằng các enzym CYP4 thuộc về các phân họ khác nhau có thể có các phản ứng khác nhau đối với các chất ngoại lai, điều này có thể liên quan đến chức năng của chúng. Những kết quả trái ngược về tác động của các chất ngoại lai lên sự phong phú của các isoform CYP4 cũng đã được thấy ở các loài không xương sống. Biểu hiện của một isoform CYP4 trong giáp xác Nereis virens đã được tìm thấy tăng 2.6 lần khi bị kích thích bởi benz (a) anthracene (0.015 mg g−1 trầm tích) (Rewitz, Kjellerup, Jørgensen, Petersen & Andersen 2004).
Ngược lại, biểu hiện mRNA CYP4Y1 trong Mytilus galloprovincialis đã thấy giảm theo cách liều phản ứng sau khi tiếp xúc với β-naphthoflavone (0.5 hoặc 5.0 mg L−1) (Snyder 1998). Kết quả của chúng tôi nhất quán với kết quả sau, biểu hiện mRNA đã giảm trong suốt quá trình sử dụng 200 mg kg−1 FLR và trở lại mức ban đầu vào ngày thứ 3 sau khi ngừng kháng sinh. Cần có thêm các nghiên cứu để rõ ràng xác định mối liên kết giữa việc sử dụng đường uống các thuốc kháng sinh và quá trình chuyển hóa trong L.vannamei.
Trong giáp xác, tụy gan là trung tâm chuyển hóa chính cho sự giải độc của các chất ngoại lai (Zhou, Wang, Wang, He, Zhou, Liu & Xu 2009; Gonçalves-Soares et al. 2012). Trong nghiên cứu này, hoạt động EROD và GST khác nhau giữa mang và tụy gan ngay cả trong điều kiện đối chứng. Những kết quả này gợi ý rằng chức năng cụ thể của mô và tỷ lệ chuyển hóa có thể ảnh hưởng đến hoạt động của các enzym chống oxy hóa trong tôm trắng. Tụy gan được coi là nhạy cảm hơn với các chất ngoại lai trong quá trình chuyển đổi do tỷ lệ chuyển hóa cao và vai trò của nó trong tiêu hóa, lưu trữ các chất dự trữ, chuyển hóa lipid và carbohydrate, hấp thụ và các quá trình giải độc (Fang et al. 2013).
Kết luận
Tóm lại, các hồ sơ dược động học của FLR đã được thể hiện, và sự hấp thụ nhanh chóng, phân phối rộng rãi và thải trừ nhanh của loại thuốc này cũng đã được chứng minh. Trong tôm trắng, FLR được phân phối rộng rãi hơn và thải trừ nhanh hơn trong tụy gan so với các mô khác. Nghiên cứu này đã chỉ ra rằng việc sử dụng đường uống FLR ở L. vannamei dẫn đến sự điều chỉnh khác nhau của hệ thống chuyển hóa. Hơn nữa, có sự tăng cường phiên mã của các gen CYP1A1, CYP3 và GST trong tụy gan, nhưng có tác động khác biệt đối với mức độ biểu hiện của CYP4.
Các kết quả thu được từ nghiên cứu này cung cấp thông tin quý giá về việc thiết lập mối liên kết giữa hệ thống chuyển hóa và việc sử dụng kháng sinh ở tôm trắng. Do đó, các kết quả này sẽ có ảnh hưởng đến việc cung cấp các chiến lược quản lý hiệu quả trong việc duy trì phúc lợi của tôm và các quy trình chăn nuôi hợp lý. Các hoạt động EROD và GST ở mang và tụy gan, biểu hiện mRNA của CYP1A1, CYP3 và GST trong tụy gan đã bị ảnh hưởng bởi cả điều trị và thời gian tiếp xúc sau khi sử dụng đường uống. Những thông số này có thể là các chỉ số tiềm năng cho việc đánh giá kháng sinh.
Cảm ơn
Nghiên cứu này được hỗ trợ bởi Dự án Nghiên cứu Công nghiệp Công cộng Quốc gia về Hải dương “kỹ thuật tối ưu hóa sinh thái môi trường nuôi trồng thủy sản quy mô lớn và tích hợp, trình diễn” (201305005). Chúng tôi cảm ơn nhân viên tại Phòng thí nghiệm Sinh lý Môi trường của Động vật Thủy sản đã giúp đỡ trong việc lấy mẫu và chăm sóc tôm.
Đọc thêm
Bạn có thể xem báo cáo đầy đủ và danh sách tác giả bằng cách nhấp vào đây.
Tháng Hai 2015
Nguồn : https://thefishsite.com/articles/effect-of-florfenicol-on-white-shrimp


