Cả hai biocide được thử nghiệm đều có hiệu quả ức chế tỷ lệ xuất bào tử
Microsporidia là một ngành lớn [thứ bậc phân loại cho các sinh vật có kiểu hình cơ thể tương tự] bao gồm hơn 1400 loài nấm đơn bào và ký sinh trùng liên quan đến eukaryotes [các sinh vật có tế bào có nhân được bao quanh bởi màng nhân]. Chúng có khả năng lây nhiễm cho nhiều loại vật chủ thủy sinh và trở thành tác nhân gây bệnh có ý nghĩa lớn trong môi trường nước nơi đây đã trở thành một vấn đề nổi cộm. Vào năm 2004, một loài microsporidia không được đặt tên đã được báo cáo lần đầu tiên trong tuyến gan tụy của tôm hùm đen Penaeus monodon bị ảnh hưởng bởi sự phát triển chậm ở Thái Lan.
Tuy nhiên, đến năm 2009, tác nhân gây bệnh này mới được xác định và điều tra một cách đầy đủ và được nhận diện là Enterocytozoon hepatopenaei (EHP), và bệnh rất nghiêm trọng mà nó gây ra ở tôm được gọi là microsporidiosis gan tụy (HPM). Tác nhân gây bệnh này đã được tìm thấy ở tôm hùm đen, tôm chân trắng (P. vannamei) và có thể là tôm kuruma (Marsupenaeus japonicus), và đã được báo cáo ở một số quốc gia có ngành nuôi tôm lớn như Trung Quốc, Việt Nam, Indonesia, Brunei, Ấn Độ, Malaysia, khu vực Australasian (nghi ngờ), Venezuela và Mexico (có thể khác loài).
EHP có thể truyền lây theo chiều ngang thông qua việc sống chung với các mẫu vật nhiễm bệnh, ăn thịt lẫn nhau, nước, đất hoặc thiết bị ô nhiễm. Chu kỳ sống của microsporidia được chia thành ba giai đoạn chính, bao gồm sự phát triển (merogeny), sản xuất bào tử (sporogeny) và giai đoạn lây nhiễm (bào tử trưởng thành). Các bào tử thường có hình oval, kích thước nhỏ khoảng 1 đến 4 μm và chứa một sợi cực có bốn đến năm vòng mà có thể được xuất ra và dùng để xuyên vào tế bào của vật chủ và tiêm chất gây nhiễm. Chúng có thể được tìm thấy trong ống biểu mô gan tụy. Trong nhiều năm, đã có báo cáo rằng dấu hiệu chính của nhiễm EHP là tăng trưởng chậm ở tôm bị ảnh hưởng và không có dấu hiệu bên ngoài nào rõ ràng; tuy nhiên, những nhiễm trùng này có thể là yếu tố nguy cơ cho các tác nhân cơ hội có khả năng khởi đầu các nhiễm trùng thứ cấp.
https://www.aquaculturealliance.org/advocate/white-feces-syndrome-shrimp-predictor-ehp/
Khi ngành nuôi tôm ngày càng gia tăng và mở rộng quy mô sản xuất, các bệnh vẫn tiếp tục đóng vai trò quan trọng trong thành công của nó. Một phương pháp phổ biến để điều trị các bệnh trong các trang trại thủy sản là áp dụng hóa chất trong các chiến lược phòng ngừa hoặc khắc phục để kiểm soát tác động của bệnh và môi trường trong ao. Trong trường hợp EHP, đã có sự nhầm lẫn về các tác nhân gây bệnh của EHP, thường được liên kết với các bệnh khác như bệnh hoại tử gan tụy cấp tính (AHPND), còn được gọi là Hội chứng Tử vong Sớm (EMS).
Từ các kết quả trước đây của một mô hình thách thức đồng nhiễm, đã rút ra một số kết luận quan trọng về sự hủy hoại tăng tốc của các mô hình gan tụy và độ nhạy cảm của tôm đối với Vibriospp. gây ra AHPND/EMS và hoại tử gan tụy nhiễm trùng (SHPN).
Thêm vào đó, một nghiên cứu khác đã tìm thấy mối tương quan giữa EHP và hội chứng phân trắng (WFS) trong khi một lượng lớn bào tử EHP đã được định lượng trong phân của tôm nhiễm WFS. Chẩn đoán EHP có thể thông qua kính hiển vi (mẫu ướt của mô gan tụy), các phương pháp phân tử (PCR) và phân tích mô (mô học hoặc in situ lai ghép).
Phát triển các hoạt chất bề mặt và điều trị bằng thuốc cho EHP là một trong những phương pháp thích hợp để kiểm soát EHP. Vẫn còn cơ hội cho một số lượng lớn các sản phẩm có thể được nghiên cứu về khả năng điều trị và kiểm soát nhiễm EHP, chẳng hạn như biocide [chất hóa học được sử dụng để tiêu diệt hoặc kiểm soát các sinh vật có hại]. Trong bài viết này, các kết quả và quan sát thu được từ việc nghiên cứu tác động của biocide của hai sản phẩm thương mại, Aqua-Protect và Antizol (được sản xuất bởi Virbac Việt Nam), sẽ được trình bày. Mục tiêu của nghiên cứu này là xác định tiềm năng của hai tác nhân biocide này đối với tỷ lệ xuất bào tử EHP trong điều kiện phòng thí nghiệm thông qua các nghiên cứu in vitro.
Cài đặt nghiên cứu
Hai lô tôm nhiễm EHP khác nhau được lấy từ hai nguồn khác nhau về mặt địa lý: Tỉnh Pathum Thani (Lô 1) và Chanthaburi (Lô 2) ở Thái Lan. Những con tôm này được thích ứng ở nhiệt độ dao động từ 28 đến 29 độ C với khí oxi liên tục trong phòng thí nghiệm trong 2 ngày (Đơn vị dịch vụ tại Centex Shrimp, Đại học Mahidol, Bangkok) trước khi tuyến gan tụy của chúng được thu thập và sử dụng để tinh chế bào tử EHP theo phương pháp đã công bố của Aldama-Cano et al. (2018). Tỷ lệ xuất bào tử được đo và thông báo lần lượt là 77.0±2.65% và 70.3±2.08% cho lô 1 và lô 2 của các bào tử EHP.
Chuẩn bị các dung dịch thử nghiệm của hai biocide thương mại như sau: Aqua-Protect và Antizol được pha loãng trong nước cất để tạo thành dung dịch gốc 1000 ppm, sau đó được pha loãng thêm đến 1, 5 và 10 ppm cho Aqua-Protect, và 10, 20 và 40 ppm cho Antizol để thử nghiệm trên Lô 1 của các bào tử EHP. Đối với Lô 2 của các bào tử EHP, Aqua-Protect được pha loãng đến 1, 5, 10 và 20 ppm, và Antizol được pha loãng đến 10, 20, 40 và 80 ppm từ dung dịch gốc 1000 ppm (Bảng 1). Đối với cả hai lô, các dung dịch đã được chuẩn bị 10 đến 20 phút trước khi thêm bào tử hoạt tính tinh chế, và thí nghiệm được thực hiện ở nhiệt độ phòng (~25 độ C).
Phan, Xuất bào tử EHP, Bảng 1
| Hợp chất biocide | Lô 1 của EHP | Lô 2 của EHP | |||||
|---|---|---|---|---|---|---|---|
| Aqua-Protect | 1 ppm | 5 ppm | 10 ppm | 1 ppm | 5 ppm | 10 ppm | 20 ppm |
| Antizol | 10 ppm | 20 ppm | 40 ppm | 10 ppm | 20 ppm | 40 ppm | 80 ppm |
Bảng 1. Nồng độ làm việc chuẩn bị của các dung dịch thử nghiệm.
Về các thử nghiệm xuất bào tử, các thử nghiệm ức chế bào tử EHP được thực hiện trong các ống phản ứng 100 µL. Mỗi ống được chuẩn bị bằng cách thêm bào tử EHP tinh chế vào từng nồng độ của các sản phẩm đã pha loãng để đạt được nồng độ bào tử cuối cùng là 104 bào tử/µL. Các thử nghiệm đối chứng được thực hiện trong nước cất vô trùng (SDW) thay cho các dung dịch thử nghiệm. Tất cả các phản ứng được ủ trong 120 phút ở nhiệt độ phòng (~25 độ C). Để tính toán tỷ lệ xuất bào tử, 3 µL của mỗi phản ứng được đặt lên một phiến kính cùng với 10 µL của 2 phần trăm Phloxin B và 10 µL của 0.2 phần trăm cellulose, sau đó được ủ trong 10 phút. Một trăm bào tử đã được đếm và ghi nhận là bào tử đã xuất hay không xuất. Mỗi phản ứng được đếm dưới kính hiển vi ba lần để tính toán tỷ lệ xuất trung bình, và tỷ lệ này sau đó được chia cho tỷ lệ xuất của điều trị đối chứng tương ứng của mỗi lô để tính toán tỷ lệ xuất chuẩn hóa (Hình 1).
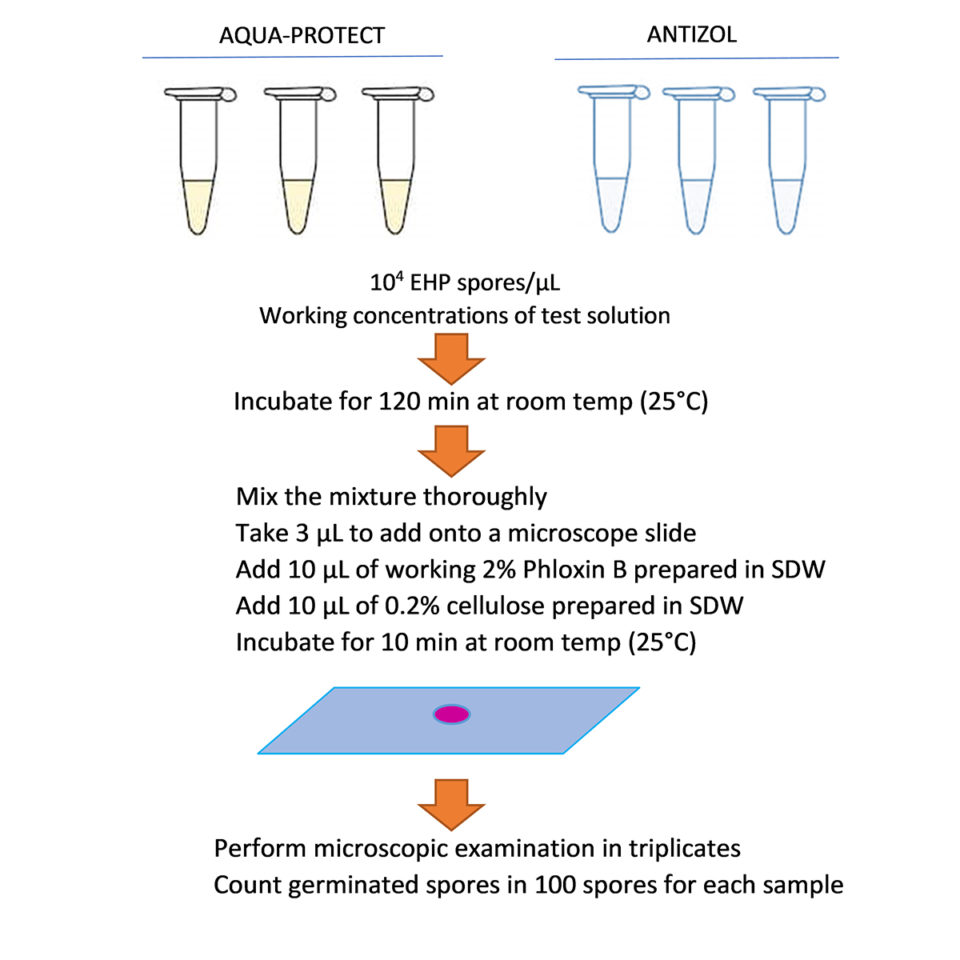
Dữ liệu được phân tích bằng phân tích phương sai một chiều (ANOVA) – sử dụng SPSS phiên bản 22 (IBM). Phép thử nhiều lần của Duncan đã được áp dụng để so sánh nhiều sự khác biệt có ý nghĩa giữa các điều trị (p
Kết quả và thảo luận
Các thử nghiệm xuất bào tử in vitro được thực hiện với hai lô bào tử EHP được thu thập từ hai nguồn khác nhau của tôm nhiễm EHP. Tỷ lệ xuất bào tử của các điều trị đối chứng lần lượt là ~77.0% và ~70.3% từ lô bào tử đầu tiên và thứ hai (Bảng 1). Những giá trị này đã được sử dụng để chuẩn hóa tỷ lệ xuất bào tử của các bào tử đã được điều trị trong các lô thí nghiệm tương ứng của chúng.
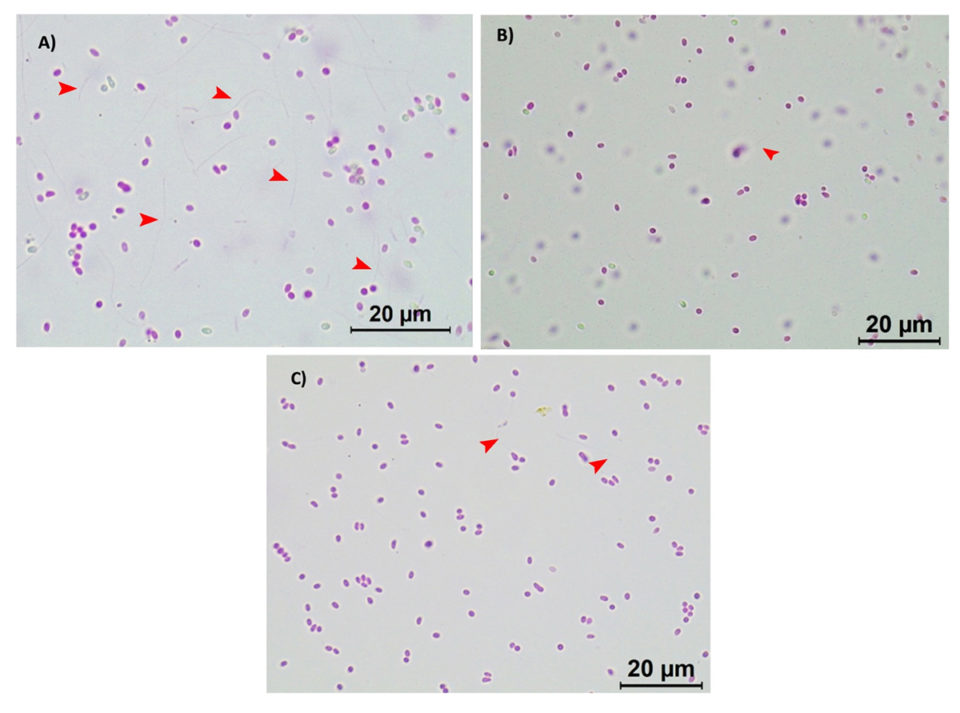
Chúng tôi nhận thấy rằng cả hai lô bào tử EHP hoạt tính đều phản ứng với điều trị bằng biocide theo cách tương tự. Dưới kính hiển vi ánh sáng (Leica, phóng đại 100×), một số lượng lớn bào tử đã được xuất có thể quan sát thấy trong điều trị đối chứng (Hình 2A; nơi các ống cực đã được xuất cho thấy giai đoạn hoạt động và lây nhiễm của chúng), trong khi một sự giảm đáng kể về xuất bào tử ống cực đã được quan sát ở các bào tử EHP hoạt tính đã được điều trị với 20 ppm Aqua-Protect (Hình 2B) và 80 ppm Antizol (Hình 2C). Phân tích thống kê đã chỉ ra một sự khác biệt đáng kể (p
Phan, Xuất bào tử EHP, Bảng 2
| Aqua-Protect | Lô 1 | Lô 2 | Antizol | Lô 1 | Lô 2 |
|---|---|---|---|---|---|
| Điều kiển | 100±2.65a | 100±2.08A | Điều kiện | 100±2.65x | 100±2.08X |
| 1 ppm | 59.74±3.61b | 80.57±3.79B | 10 ppm | 9.96±1.15y | 17.06±1.00Y |
| 5 ppm | 38.96±8.66c | 33.18±6.66C | 20 ppm | 14.29±1.00y | 9.00±2.52Y |
| 10 ppm | 36.80±3.51c | 18.96±3.51D | 40 ppm | .36±1.53y | 9.00±2.31Y |
| 20 ppm | N/D | 4.74±0.58E | 80 ppm | N/D | 3.32±1.53Y |
Bảng 2. Tỷ lệ xuất bào tử EHP đã chuẩn hóa sau hai giờ điều trị. Dữ liệu được trình bày dưới dạng trung bình ± độ lệch chuẩn của tỷ lệ xuất bào tử (phần trăm, %) đã được chuẩn hóa so với tỷ lệ xuất của điều trị đối chứng tương ứng của chúng.
N/D – Không thực hiện. Các chữ cái khác nhau có sự khác biệt có ý nghĩa với nhau trong cùng một cột (p
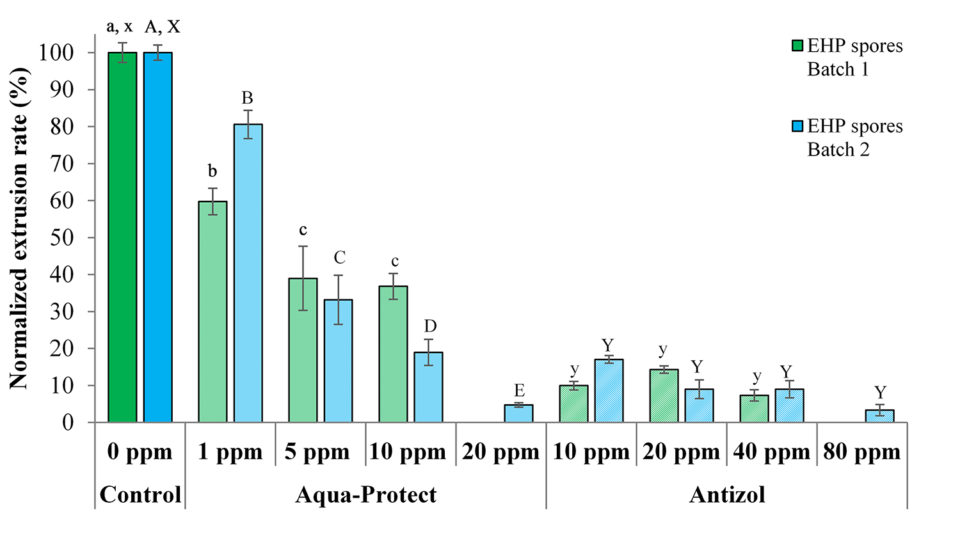
Dữ liệu từ các thử nghiệm cho thấy rằng các biocide có hiệu quả chống lại cả hai lô bào tử EHP bằng cách ức chế xuất ống cực bào tử sau 120 phút ủ (Bảng 2 và Hình 3). Đối với Antizol, tỷ lệ ức chế tối đa dao động từ 92.6% (Lô 1, 40 ppm) đến 96.7% (Lô 2, 80 ppm), trong khi đối với Aqua-Protect, tỷ lệ ức chế từ 63.2% (Lô 1, 10 ppm) đến 95.2% (Lô 2, 20 ppm).
So sánh hai sản phẩm, Antizol có hiệu quả hơn Aqua-Protect ở cùng liều 10 ppm, trong khi Aqua-Protect lại có hiệu quả hơn Antizol ở liều 20 ppm (Bảng 2 và Hình 3). Tác động ức chế của Aqua-Protect được phát hiện là phụ thuộc vào liều, vì sự gia tăng nồng độ từ 1 ppm đến 20 ppm dẫn đến sự giảm tỷ lệ xuất. Tuy nhiên, tỷ lệ xuất sau khi áp dụng Antizol không giảm đáng kể khi liều tăng từ 10 ppm.
Kết luận
Kết quả của nghiên cứu của chúng tôi trình bày ở đây cho thấy rằng các biocide Aqua-Protect và Antizol đã có tác động ức chế đối với tỷ lệ xuất bào tử EHP khi được điều trị in vitro trong điều kiện phòng thí nghiệm. Trong khi cả hai biocide dường như ức chế xuất bào tử trong một môi trường phòng thí nghiệm nghiêm ngặt, cần xem xét nhiều yếu tố khi tối ưu hóa quy trình sử dụng chúng tại hiện trường, chẳng hạn như mức độ độc tố đối với động vật (dữ liệu có sẵn), phương pháp/chiến lược ứng dụng, nồng độ làm việc tối ưu, diện tích hoặc khối lượng nước cần được điều trị và những yếu tố khác.
Cũng cần phải xác định xem phương pháp dự phòng hay phòng ngừa có phù hợp hơn so với phương pháp khắc phục, vì hầu hết các hóa chất được đánh giá để có thể chống lại nhiễm EHP đã được khuyến cáo để sử dụng giữa các vụ mùa như một biện pháp an toàn sinh học phòng ngừa. Khi phương pháp tốt nhất được xác định, việc sử dụng các chất khử trùng như biocide để kiểm soát nhiễm EHP có thể trở thành một phương pháp phổ biến cho cả những người nuôi tôm bị ảnh hưởng và không bị ảnh hưởng.
Các tài liệu tham khảo có sẵn từ tác giả tương ứng.
Nguồn : https://www.globalseafood.org/advocate/in-vitro-evaluation-of-two-commercial-biocides-on-ehp-spore-extrusion-rate/


